肝臟占位性病變可以是良性或惡性的腫瘤,惡性腫瘤可以是轉移的或原發的。原發性肝癌(primary carcinoma of the liver)是我國常見惡性腫瘤之一。死亡率高,在惡性腫瘤死亡順位中僅次于胃、食道而居第三位,在部份地區的農村中則占第二位,僅次于胃癌。我國每年死于肝癌約11萬人,占全世界肝癌死亡人數的45%。由于依靠血清甲胎蛋白(AFP)檢測結合超聲顯像對高危人群的監測,使肝癌在亞臨床階段即可和出診斷,早期切除的遠期效果尤為顯著。加之積極綜合治療,已使肝癌的五年生存率有了顯著提高。原發性肝癌(primary liver carcinoma,PLC)的種類見表1。
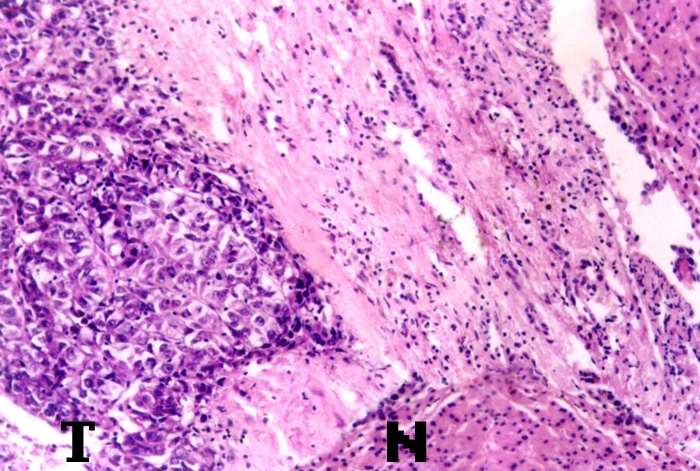
表1 原發性肝癌的種類
*肝細胞性:
•肝細胞癌
•肝胚細胞瘤(hepatoblastoma)
*膽管性:
•膽管細胞癌(cholangiocarcinoma)
•囊腺癌(cystadenocarcinoma)
* 肝-膽管混合細胞癌
*其它:
•肉瘤(sarcoma)
•血管內皮細胞(hemangioendothelial)肉瘤
•上皮樣血管內皮細胞瘤(epithelioid hemangio-endothelioma)
•纖維板層(fibrolamellar)癌
原發性肝癌發病率因地區而異,以非洲和東南亞較高。在我國也是常見的惡性腫瘤之一,每10萬人口年發生率為14.6%—46.0%,以江蘇啟東和廣西隆安在全國最高。死亡率僅次于胃癌和食道癌,每年因原發性肝癌的死亡人數約12萬,約占世界原發性肝癌死亡人數的40%。其中肝細胞癌(hepatocellular carcinoma,HCC)占原發性肝癌的90%。
一、肝細胞癌的病因
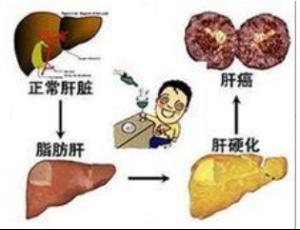
肝細胞癌可由于多種病因引起,當前在我國HBV感染是最重要的。
(一) 乙型肝炎病毒(HBV)感染和其它病因:在肝細胞癌多種病因中,當前在我國乙型肝炎病毒感染是最重要的。其它病因大多作為乙型肝炎病毒感染的協同因素,但亦有少數肝細胞癌可能與乙型肝炎病毒感染完全無關。
1.乙型肝炎病毒:當前在我國的肝細胞癌病人中多數可檢出HBsAg,HBsAg(一)的肝細胞癌也多能在肝內檢出乙型肝炎病毒DNA。在我國,肝細胞癌是乙型肝炎病毒感染的常見并發癥。其病因關系已在第三十章討論。
2.丙型肝炎病毒(HCV):HCV感染引起慢性肝炎(CH),可進展至肝硬變(LC)甚至肝細胞癌。慢性HCV感染在10—30年后可有5%一10%發展至肝細胞癌,在肝硬變病人中HCC的累積發生率超過50%。近年一些國家的調查資料表明,肝細胞癌病人中抗丙型肝炎病毒的檢出率為13%一80%。日本在近10年中,HBV和丙型肝炎病毒感染對肝細胞癌的病因學的重要性正在轉變,HBsAg的檢出率已降至25%以下,而在70%以上的病人可檢出丙型肝炎病毒抗體。可能當年日本兒童使用未消毒注射器獲得HCV感染;而西方常為靜脈藥癖的成人感染,日本人丙型肝炎病毒感染時間較長而肝細胞癌的發生率較高。然而,在丙型肝炎病毒感染高發的國家,肝細胞癌雖較多與丙型肝炎病毒相關,在HBV感染者中的肝細胞癌發生率仍高過丙型肝炎病毒感染者中肝細胞癌的發生率。
我國初步的血清學調查表明:肝細胞癌病人中抗丙型肝炎病毒的檢出率僅10%一20%,且大部分是丙型肝炎病毒和HBV的雙重感染。在肝細胞癌高發地區的調查,發現在肝細胞癌病人中檢出HBV標志物可達90%、而抗丙型肝炎病毒僅約5%;抗丙型肝炎病毒檢出率在HBsAg(十)、與在HBsAg(一) 肝細胞癌病人中并無顯著差別。
在丙型肝炎病毒基因組中未檢出類似的癌基因,亦不與細胞基因整合。丙型肝炎病毒的致癌機制不明,可能的高危因素是肝細胞的炎癥壞死和肝硬變。在癌和癌外組織中檢出的負鏈丙型肝炎病毒 RNA含量接近正鏈;而血清中負鏈比正鏈少1000倍。負鏈是丙型肝炎病毒的復制中間體,這一發現可能與癌變的機制有關。
3.真菌毒素:最重要的是由黃曲霉菌產生的黃曲霉素B,污染食物如花生和稻谷,貯存在熱帶地區者尤易發生。不同地區黃曲霉毒素的攝入量與HCC的發生率相關。AFB1在肝內的代謝產物可能是一種環氧化物,與DNA分子的鳥嘌呤共價結合,干擾DNA的轉錄,可能因而引起DNA突變。但急性黃曲霉毒素中毒的存活者隨訪5年,未發現有肝硬變或肝細胞癌。可能,黃曲霉毒素主要作為HBV感染的協同致癌原。我國啟東、隆安、崇明等肝癌高發地區,既有HBV感染高流行、又是AFB重度污染區。可能,HBVDNA整合入肝細胞基因組,而AFB和核酸可形成加成物(adduct),從而改變肝細胞的基因表達。HBV感染,使肝細胞對致癌化合物的代謝改變,或影響細胞DNA化學損傷的修復過程。
4.酒精:常同時有HBV感染和肝硬變,酒精、或其肝病并不引起癌變,可能只是一個協同因素。酒精抑制免疫應答可能促使癌變。
(二)肝硬變(LC)與肝癌:死于肝硬變的病人,尸解發現有30%一40%有肝細胞癌;而90%的肝細胞癌病人發生于肝硬變的基礎上。不論肝硬變的病因為何,可將其看作是肝細胞癌最重要的高危因素。
肝細胞生理狀態下的再生只是替代單個衰老細胞,按小葉梯度,多發生在腺泡的第1區帶,沿網狀支架,保持細胞·細胞間的正常接觸。肝硬變時肝細胞在炎癥壞死區域中再生,失去細胞極性,不按小葉結構,微血管混亂,高度增生形成結節。肝硬變時肝細胞再生是癌變的關鍵因素,與正常肝臟不同,有生長因子產生和異常癌基因表達。這種再生的肝細胞易于接受變異原的作用。再生結節、尤其是大結節性肝硬變的再生結節,是肝細胞癌發生的基礎。
我國的肝細胞癌絕大多數與慢性HBV感染有關,絕大多數經歷CH、肝硬變而至肝細胞癌。肝細胞炎癥壞死可能對癌變有重要作用。在病毒復制和病變活動的肝硬變,壞死和再生的重復周期,肝細胞分裂;非整倍體性促使肝細胞基因變異,易于惡性轉化。因而在標志肝硬變病變進展的Child分級中,癌變率隨其級別而增高。
西方國家的肝細胞癌亦多來自肝硬變,但僅約20%可檢出HBsAg。可能,隨肝細胞的炎癥壞死伴隨的增生過程中,出現的轉化細胞可經克隆性增殖,而衍生為肝細胞癌。腺瘤性增生似即為癌前病變。另外,肝細胞癌還可發生在沒有肝硬變的HBV感染的肝臟,在WHV感染的土撥鼠肝細胞癌亦常無肝硬變。因而,肝細胞癌是多病因的,不同病人有不同因素的結合,在HBV感染者亦須有一些協同因素。
二、小肝細胞癌的概念
國際小組定義小肝癌小于2cm,邊界清楚,周圍可伴有或不伴有包膜,包膜可完整或不完整,包圍瘤結節的是真包膜或僅是密集的肝硬變基質。有包膜的小肝癌呈圓形,分化好,生長緩慢、甚至在1—2年中保持大小不變;不規則形狀無包膜的小肝癌生長較快,較早出現子結節和衛星結節。
我國的小肝癌多無包膜或包膜不全。肝細胞癌多以擴張型、較少以浸潤型生長。一般多由單一中心起源,分化較好的生長較慢;即使是彌漫型的肝細胞癌,也可是單克隆瘤細胞肝內門脈廣泛轉移的結果。其實,肝細胞癌的生長并不迅速,自腫瘤發生至出現明顯癥狀可能要幾年;出現黃疸和肝脾腫大由于生長速率加快,出現癥狀后則僅能存活幾個月。小肝癌與有癥狀肝癌的發展是不同的。小肝癌是早期的肝細胞癌,有肝細胞癌的固有特征。
腺樣增生可能是癌前病變的再生大結節,有時易與高分化的小肝癌混淆,既須注意鑒別,更須警惕其發展為肝細胞癌。
三、肝細胞癌的臨床表現
起病常隱匿,多在肝病隨訪中或體檢普查中應用AFP及B型超檢查偶然發現肝癌,此時病人既無癥狀,體格檢查亦缺乏腫瘤本身的體征,此期稱之為亞臨床肝癌。一旦出現癥狀而來就診者其病程大多已進入中晚期。不同階段的肝癌,其臨床表現有明顯差異。性別:男;女=4—6:1,與慢性HBV感染多發于男性一致。年齡:可發生于任何年齡,我國以40一60歲為多。HBV相關者的平均年齡約50歲、HCV相關者約大10歲。可能因HBV感染多在嬰幼兒期,而HCV感染多在成年期。
1、癥狀:肝細胞癌的臨床表現有典型的、特殊的和轉移引起的(表2)。
表2 肝細胞癌的臨床表現
*典型表現
·肝區疼痛
·肝腫大,表面硬結節
·肝硬變征狀:黃疽、腹水、脾腫大
·全身征狀:發熱、衰竭、消瘦
*特殊表現(伴癌綜合癥)
·低血糖
·高血鈣
·高膽固醇
·紅細胞增多癥
·甲狀腺功能亢進
*癌腫轉移的表現
·肺:呼吸困難、右側胸水
·骨:壓痛、神經壓迫征狀
·腦:顱內腫瘤的征狀
·淋巴腺;右鎖骨上腺體腫大
2、典型表現
肝區疼痛:半數以上病人有之,多呈持續性脹痛或鈍痛,多在腫瘤的位置,疼痛是由于腫瘤增長快速,拉緊局部肝包膜所致;如生長緩慢,可完全無痛或僅有輕微疼痛。如侵犯橫膈,可放射右肩。如肝表面的癌結節破裂,壞死的癌組織和血液流入腹腔時,可突然引起腹部劇痛,同時有腹膜刺激癥狀。
肝腫大:肝進行性腫大,不僅下向腹腔,且上向胸腔。表面有硬而不規則的結節或巨塊,可無壓痛或有難以忍受的壓痛。肝癌突出在右肋緣下或劍突下時,上腹部呈局部隆起或飽滿;如癌腫位于橫膈面,有橫膈抬高而下緣可大腫大。因腫瘤壓迫肝動脈或腹主動脈,有時可在腹部的相應部位聽到風樣血管雜音。
黃疸:一般在晚期出現。常因肝細胞損害而引起,少數由于腫瘤壓迫、侵犯肝門附近的膽管、癌組織脫落引起膽道梗阻所致。少有深度黃疸。
肝硬變征狀:可有脾腫大、腹水、靜脈側枝循環形成等。
腹水:約半數病人有之。由于門脈高壓,門脈瘤栓亦可參與。蛋白含量高。可發現惡性細胞,須與腹膜細胞鑒別。可為血染,癌腫破裂引起血腹,可隱襲性發生或作為一種急腹癥。
惡性腫瘤的全身性表現:發熱、食欲不振、疲乏、營養不良、進行性消瘦和惡病質等。
伴癌綜合癥:可有血液、內分泌、代謝等多方面的表現(表4),但僅少數病人有之。以低血糖癥和紅細胞增多癥較多見,還有高血鈣、高血脂等,對肝腫大且伴有這類表現的病人,應警惕肝細胞癌的存在。
高血鈣可由于假性甲狀旁腺功能亢進,肝細胞癌中可含有甲狀旁腺素樣物質,血清甲狀旁腺素水平增高。
低血糖可見于30%的病人,常是迅速進展的低分化性腫瘤,可能由于腫瘤細胞對葡萄糖的高額需求,少數由于獲得性糖原貯積病,腫瘤及其鄰近組織糖原增加而葡萄糖—6—磷酸酯酶(G6PT)和磷酸化酶減少。后一情況即使用大量糖亦較難控制。
高血脂少見,但有約1/3病人即使低膽固醇飲食,血清膽固醇水平亦可增高。
甲狀腺功能亢進可由于腫瘤產生甲狀腺刺激素。
紅細胞增多癥(erythrocytosis)見于1%的病人,血紅蛋白超過160rug兒。可能由于腫瘤產生紅細胞生成素(erythropoietin)增加。
3、腫瘤轉移表現
如發生肺、骨、腦和淋巴結等處轉移,可產生相應癥狀。淋巴腺可觸及,尤其是右鎖骨上區。胸腔轉移以右側多見,可有胸水征,廣泛的肺栓子可致呼吸困難和肺高壓。骨骼或脊柱轉移可有局部壓痛或神經壓迫癥狀。顱內轉移可有腦瘤及其神經定位體征。
4、臨床分型
①單純型:病理有肝硬變病變,臨床并無明顯肝硬變表現。肝功能檢查基本正常。②肝硬變型:臨床或實驗室檢查有肝硬變表現。⑧肝炎型:發生于活動性肝硬變的病人,ALT顯著增高,可有黃疸和發熱。
5、并發癥
肝性昏迷:終末期表現。
上消化道出血:約占致死原因的15%,由于LC或門靜脈、肝靜脈瘤栓引起門脈高壓而出血;后期可因胃腸道粘膜糜爛、潰瘍和凝血功能障礙而致廣泛出血。
肝癌結節破裂出血:約10%的病人因而致死。癌腫發展、壞死液化時可自發破裂,亦可因外力而破裂。破裂可限于肝包膜下,產生局部疼痛,或迅速增大成為壓痛性腫物;亦可破入腹腔引起急性腹痛、腹膜刺激征和休克。
6、肝癌的自然病程
據國內一組經病理證實而未經手術切除的亞臨床肝癌的觀察,以出現低濃度AFP至亞臨床肝癌(早期)診斷確立;自亞臨床期亞出現臨床癥狀(中期);自有臨床癥狀至黃疸、腹水或遠處轉移或惡液質(晚期);自晚期至死亡,其中間隔時間分別為10、8、4和2個至少為24個月。過去認為肝癌病程短,僅3~6個月,實際上這僅反映了相當于晚期的肝癌病程。
7、臨床分期:
(1)根據全國肝癌研究協作會議擬訂的分期標準:
Ⅰ期: 無明顯癥狀和體征,又稱亞臨床期。
Ⅱ期: 出現臨床癥狀或體征但無Ⅲ期表面者。
Ⅲ期: 有明顯惡液質、黃疸、腹水、或遠處轉移之一者。
Ⅰ期肝癌為亞臨床期,其中經手術證實腫瘤為單個結節,直徑小于5cm者稱之為小肝癌;故多數小肝癌為亞臨床肝癌或Ⅰ期肝癌。但下列情況例外,即肝癌雖小但近肝臟邊緣或帶蒂下垂易被捫及者;早期出現遠處轉移者;或癌結節雖小但長在肝臟表面易破裂出血、急腹癥者。反之,腫瘤長在非要害部位,即使腫瘤結節直徑大于5cm亦可不出現癥狀體征,故亞臨床癌亦包括一部分大于5cm直徑的腫瘤。
(2)肝腫瘤TNM分期標準 近年來我國已將國際抗癌聯盟規定的TNM分期標準用于肝腫瘤的分期,其表述如下。
日本肝癌研究支根據TNM分期擬定了一個Ⅰ~ⅣB的分期方法,其法如下:
Ⅰ期 T1 No Mo
Ⅱ期 T2 No Mo
Ⅲ期 T1 No Mo
T2 N1 Mo
T3 N1或N1 Mo
Ⅳ期 T4 No或N1 Mo
Ⅳ期 T1~T4 No或N1 M1
T-原發腫瘤 N-淋巴結 M-轉移
T1 孤立的腫瘤,最大直徑在2cm或以下,無血管浸潤。
T2 T1中三項條件之一不符合者。
T3 T1三項中有二項不符合者。
T2,T3二者中包括多發腫瘤但局限于一葉者。(為便于發期,劃分肝兩葉之平面設于膽囊床與腔靜脈之間)。
T4 多發腫瘤分布超過一葉,或腫瘤累及門靜脈或肝靜脈的主要分支。
N-局部淋巴結 No 無局部淋巴結轉移。
N1 局部淋巴結轉移
M-遠處轉移 Mo 無遠處轉移。
M1 遠處轉移。
四、肝細胞癌的血清學診斷
慢性肝病(CLD)的病人近期出現明顯肝區疼痛、消瘦和進行性衰弱,出現肝臟表面結節,出現肝區血管雜音,出現血性腹水或經積極處理腹水不消,都須考慮癌變的可能性。肝細胞癌常須至晚期才出現癥狀,已出現晚期癥狀的肝細胞癌病人,預后常十分惡劣。早期診斷的兩個主要方面是血清標志物和影像學檢查。
(一)甲胎蛋白: 甲胎蛋白(α-fetoprotein,AFP)是當前診斷肝細胞癌最特異的標志物。甲胎蛋白是胚胎卵黃囊和腸道產生的一種糖蛋白。是胎兒的正常血漿蛋白成分,胚胎第6周開始出現,12—16周達最高水平,出生后數周消失。當成人肝細胞惡變后又可重新獲得這一功能。由于孕婦、新生兒及睪丸或卵巢的生殖腺胚胎癌亦可出現,人AFP對肝細胞肝癌僅有相對特異的診斷價值。因檢測方法靈敏度的提高,在一部份肝炎、肝硬化及少數消化道癌如胃癌、結腸癌、胰腺癌等轉移性肝癌亦可測得低濃度AFP。故AFP檢測結果,必須聯系臨床才有診斷意義。
目前多采用放射免疫法(RIA)或AFP單克隆抗體酶免疫(EIA)快速測定法檢測血清AFP含量,正常人血清中可沒理微量,小于20μg/L水平。肝細胞癌增高者占70~90%。通常AFP濃度與腫瘤大小有相關,但個體差異較大,一般認為病理分化接近正常肝細胞或分化程度極低者AFP常較低或測不出。國外公認標準往往偏高,易于漏診。我國重視中等和低濃度AFP增高的動態觀察。臨床實踐中對AFP低濃度者常須結合影像診斷技術進行隨訪,有助于及早確立診斷。肝癌常發生在慢性活性肝病基礎上故須加以鑒別。慢性肝炎,肝炎后硬化有19.9%~44.6%患者AFP增高,濃度多在25~200μg/L之間,良性肝病活動常先有丙轉氨酶明顯升高,AFP呈相隨或同步關系,先高后低,一般在1~2月內隨病情好轉,轉氨酶下降,AFP隨之下降呈“一過性”。有時良好肝病活動AFP亦可呈反復波動、持續低濃度等動態變化,但必須警惕肝病活動的同時可能有早期癌存在。
(二)其它血清標志物
1.其它腫瘤相關標志物:迄無特異性和靈敏性超過AFP的血清標志物,但如聯合AFP檢測,可能提高診斷率。
脫羧凝血酶原前體(DCP):是肝臟合成的一種異常凝血酶原,其N—端的氨基酸未經羧基化,不能與Ca++結合而無凝血活性。肝癌腫喪失羧基酶基因的表達,因而DCP增高。國內報告對HCC的陽性率為64.3%一69.4%,AFP(-)HCC中約60%。DCP的陽性率與腫瘤大小相關,對小HCC的檢出率亦不高。
癌胚抗原(carcino-embryonicantigen,CEA)在大多數CLD時都可增高,肝轉移癌時更高,缺乏特異性。
血清酶:鹼性磷酸酶(ALP)、γ谷氨酰轉肽酶(γGT)常顯著升高,但不特異,在膽紅素和轉氨酶正常時應考慮HCC的可能。同功酶包括ALP、7GT和醛縮酶等亦有輔助診斷意義。
血清鐵增高主要因腫瘤對其產生增加,與肝壞死亦有關。
2.HBVM:在我國有70%一90%的HCC病人HBsAg(+),其中約1/3可以PCR自血清中檢出HBVDNA,提示仍有病毒復制;有些病人以抗HBs作為與HBV感染聯系的標志,肝內仍存在病毒;一些血清HBVM(一)的病人可自其肝組織中檢出HBVM,提示HCC病人HBV的復制水平常較低。慢性HBV感染之后很長時期才發生癌變,HCC病人大多處于病毒復制靜止期,血清HBV和HBsAg的水平可能很低;另外,HCC時整合的HBV常有缺失變異,血清HBVM與肝內病毒的實際存在可有相當大的差距。
以病毒的血清標志物反映HCC的流行率是不充分的。極大多數HBsAg(-)、HB抗體(+)、甚至全部血清HBVM(一)的病人,仍可能檢出肝內的HBVM。慢性HBV感染之后很長時期才發生癌變,HCC病人大多處于病毒復制靜止期,血清HBV和HBsAg的水平可能很低,另外,HCC時整合的HBV常有缺失變異,血清與肝內的H13VM可以有相當大的不同。
五、肝細胞癌的影像診斷
常規X線只能診斷晚期肝細胞癌病人,可發現有右半膈肌抬高或肺有轉移。影像技術的發展可能檢出無癥狀的早期病人,使手術切除率由過去的10%增長至當前的30%。檢出肝內小結節須有性質鑒定,確定為癌瘤還須有明確的解剖學定位。
(一)超聲、CT和磁共振:
放射性核素掃描:198金、113銦、99锝、131碘玫瑰紅等以充盈缺損顯示腫瘤,可檢出大于3cm的病變。113銦肝血池顯影可與肝膿瘍、肝囊腫、血管瘤等良性占位性病變鑒別。
B型超聲顯像:可顯示腫瘤實性光團,腫瘤壞死液化時其相應部位可出現液性暗區。小的HCC呈低回聲,隨H'CC發展為等回聲或高回聲,晚期由于瘤體壞死可出現不規則回聲。檢測的準確性取決于儀器的靈敏性和檢測者的經驗。在最好的狀態可檢出直徑2cm的病變,可能發現αFP正常時的早期HCC。在擴張的門靜脈中可發現癌栓。
有時與肝硬變的大結節、轉移性腫瘤和血管瘤可不易鑒別。肥胖和腸內積氣可影響觀察,右膈下肝病變亦可被隱蔽。
在超聲引導下作肝穿刺活檢、或細針抽吸細胞學檢查,較安全,也有較高檢出率。
計算機X線體層掃描(CT):能窺見肝臟的全貌,展現腫瘤與肝門大血管、膽管的關系。肝細胞癌表現為局灶性周界清楚的密度減低區,也可為邊緣模糊、大小不等的多發陰影。可檢出1—2cm的病變。增強掃描和延遲掃描對鑒別肝細胞癌或肝血管瘤更有價值。
磁共振成像(MRl):一般認為不優于CT,亦有較高的分辨率,尤以T2加權對癌瘤范圍的界限較清楚;可與海綿狀血管瘤、囊腫、局限性脂肪沉著和再生結節進行鑒別,不必同時肝動脈造影。
海綿狀血管瘤在自然人群中的發生率可達5%一7%。可逐漸增大,直徑超過5cm時常發生中心纖維結疤。其它影象診斷有一些限制,MRI如用T2加權成像呈現高信號病灶,有較高的分辨率,可與腫瘤鑒別。
(二)肝動脈造影
由股動脈插管選擇性肝動脈造影。腫瘤血液供應主要來自肝動脈,肝細胞癌是典型的多血管性腫瘤,造影可顯示腫瘤血管的一些特征:動脈明顯擴張,腫瘤區血管走型偏移或牽伸,新形成的血管畸形或扭曲,門靜脈栓塞,有時血管硬化,管腔不規則呈節段狀,異常的血管限定在腫瘤區內,與腫瘤實際大小相符。造影可能顯示1—2cm大小的腫瘤結節,可以定位;可能發現肝內的子瘤灶。選擇性肝血管造影同時用于手術前判定肝細胞癌范圍并進行定向介入治療。
碘化油血管造影和掃描:經肝動脈注射碘化油后10一14日再進行CT檢查。造影劑被肝實質細胞攝取,Kupffer細胞能較快清除,而肝細胞癌中缺乏Kupffer細胞而造影劑仍然殘留,表現為不透光的斑點。是目前最靈敏的定位診斷方法,靈敏性85%一90%,甚至可檢出直徑0.5cm的癌結節。碘化油亦可用作化療藥物的載體,同時栓塞化療,使腫瘤壞死縮小而利于切除。
六、關于肝細胞癌的早期發現
肝細胞癌的預后取決于病期的早晚,檢出早期的小肝細胞癌更適合手術,有更長期的存活率。但其早期生長較緩慢,一個肝內的腫瘤結節并不引起明顯癥狀。高發地區曾進行人群普查以發現亞臨床小肝癌。1975—1978年上海242 911居民中用AFP普查檢出39人,檢出率僅為16/10萬,耗費過大;且有約30%的早期病例可因AFP(—)而被漏檢。
當前我國的肝細胞癌主要是慢性HBV感染發展的后果,在長期的過程中,常難發覺肝細胞癌何時發生。
在高危人群中進行篩查,可以早期發現肝細胞癌。高危人群主要是:1、HBV感染;2、慢性活動性肝病;3、35歲以上男性。在這些病人中每年兩次檢查AFP和B型超聲,可以有效地發現早期肝細胞癌。在高危人群中肝細胞癌的檢出率可超過2 000/10萬,比在自然人群中高百余倍。·每年檢查兩次的被檢出者多處于可手術切除的早期。
小肝細胞癌切除后的5年存活率與切除時的腫瘤大小相關,目前影像診斷技術已可能發現lcm的小肝細胞癌。切除2cm無血管侵犯的小肝細胞癌,其5年存活率可達60%一100%。關鍵是盡可能早期檢出最小的肝細胞癌。
對AFP增高的病例除非已明確為活動性CLD,應高度疑似肝細胞癌而進行定位診斷,甚至考慮選擇性肝動脈造影、碘化油—CT等侵入性檢查,直至剖腹探查。對于早期發現的可疑病例應盡快確診,不得在觀察中耽誤。
七、肝細胞癌的治療和預后
有癥狀的肝細胞癌病人確診后的存活期多數僅約3個月,1年存活率僅44%。偶有生長緩慢的肝細胞癌,可生存2—3年甚至更久。大塊型較結節型為差。血清膽紅素高、白蛋白低的預后更差。腫瘤大小,治療方法與腫瘤的生物學特性是影響預后的重要因素,根據我們的材料獲根治性切除者五年生存率達53.0%,其中多為小肝癌或大肝癌縮小后切除者,姑息性切除僅12.5%,藥物治療少見生存5年以上者。早期肝癌體積小,包膜完整、瘤栓少見或無、腫瘤分化好,遠處轉移少,機體免疫狀態較好,這些均是進行手術根治的有利條件。中晚期肝癌雖經多種治療綜合措施,根治機會少,易有遠處轉移預后較差。
當前預后主要取決于能否手術切除和治療干預的程度。不能切除的肝細胞癌的治療有了不少進步,存活期有所延長。但肝細胞癌仍是預后較差的惡性腫瘤,突破性進展寄希望于基因治療。
(一) 肝細胞癌的手術切除:早期手術切除是最有效的治療方法。有癥狀的肝細胞癌病人切除后5年存活率低于20%,無癥狀普查發現的病人可達60%以上。上海現有數例存活已達20余年,對早期小肝癌進行肝葉切除,可望治愈。
適應證:首選肝功能代償、小于5cm的單一腫瘤。只要癌腫局限,尚未超過半肝,未侵犯肝門、膈肌、腹膜和鄰近器官,也應盡可能手術。近年來技術的進步和經驗的累積,手術切除的適應證已有擴大。只要切除后保留的肝臟可以維持必要的功能,即使已侵犯鄰近器官,也可考慮手術,切除原發腫瘤,有利于進行進一步治療。
術式的選擇需根據病人全身情況、肝硬變發展程度、腫瘤大小和部位等。一般要求距腫瘤邊緣2—5em以外切肝。癌腫局限于一段者,可作肝葉切除;已累及一葉或剛及鄰近葉者,可作半肝切除,如已累及半肝,但無肝硬化者,可考慮三葉切除;位于肝邊緣區的腫瘤,亦可根據肝硬變的情況選擇肝部分切除或局部切除。肝切除中一般至少要保留正常肝組織的30%或硬化肝組織的50%,否則功能不能代償。肝細胞癌手術切除后仍易復發,即使是小肝細胞癌,5年復發率亦可達40%—60%。須配合全身化學藥物治療。
腫瘤對切除后的預后因素包括:腫瘤的大小、數目、包膜有無浸潤、門靜脈有未被侵襲、生長類型和范圍。決定手術切除預后的另一因素是肝功狀態,如ChildA級病人單一腫瘤3年存活率為50%、B級30%、C級0%,在失代償的病人手術病死率很高,存活期又很短。此外,高齡病人易發生術后感染和其它合并癥。
當前肝細胞癌預后還較差,問題在于;1、雖影像學可檢出lcm的癌瘤,外科技術也有很大的發展,但極大部分病人在就診時已難以切除,迄今肝細胞癌的可切除率還較低。CLD從CH、肝硬化到早期的肝細胞癌常是一個較隱匿的過程,對高危人群的篩檢還未全面系統進行。2、能切除的只是小部分病人,卻仍有相當高的復發率和再發率(再次原發性)。可由于癌瘤切除后仍繼續存在的致癌變因素,或在切除前已有瘤栓播散。應對亞臨床復發進行監測。3、肝硬化的代償肝功能,尤其有明顯活動性炎癥者罕能生存超過1年。肝細胞癌手術切除顯然延長了病人生命,但是否相應的降低了病死率還有待繼續觀察。
(二)不能切除的肝細胞癌治療
肝細胞癌惡化程度高,發病隱匿,早期診斷率低,70%的病人就診時已失去手術切除的時機。不能切除的肝細胞癌包括:1、肝功能失代償,有明顯黃疸、腹水、下肢浮腫、凝血酶原低于正常值的50%;2、癌腫分布廣泛、或已有遠處轉移、或有門靜脈或肝靜脈主干癌栓;3、全身衰竭或合并其它器官嚴重疾病;4、腫瘤緊靠門靜脈主干或下腔靜脈在切除技術上有困難。
由于近年影像學的進步、局部治療的開展、綜合治療的應用和腫瘤治療生物學概念的更新,不能切除肝細胞癌的5年存活率已可達20%以上。不能切除肝細胞癌的手術治療有:肝動脈結扎、插管、冷凍、激光、微波、術中瘤內無水酒精注射;非手術者可經肝動脈化療栓塞、放射、化療、生物學治療等。阻斷肝細胞癌血供的治療方法是不能切除病例的首選的療法。
(1)化學抗癌藥物治療:常用藥物有5-氟脲嘧啶(250--500mg,iv,qod,7.5g為一療程),還有順鉑、噻替哌、絲裂霉素、阿霉素等。化學抗癌藥物每易引起胃腸道反應和造血功能抑制,單獨應用療效多不滿意。可改進用藥方法,如采用肝動脈插管灌注、按細胞動力學原理采用聯合或序貫方案治療、盡量改善全身營養狀況等,可能取得較滿意的效果。
(2)阻斷腫瘤血供聯合化療:目前最常用有兩種方法可供選擇:A、肝動脈結扎聯合插管化療:采用解剖肝門明視插管和美藍定位,使藥物確切灌注至腫瘤區;選用埋入式導管延長了導管使用時間。在不能切除的肝細胞癌,多可使用這一聯合治療。5年存活率可近20%。有近lo%的病人,因治療后癌腫明顯縮小而可手術切除。B、經肝動脈化療栓塞:是不能切除肝細胞癌的首選非手術療法。應用最廣泛的栓塞劑是碘化油,與阿霉素合用可提高癌瘤內阿霉素的濃度。肝動脈主要供應癌結節中央區,經肝動脈栓塞其周邊常有殘癌;結合經超聲引導下肝內門靜脈支化療栓塞,可控制由門靜脈供應的周邊區。
不能切除的肝細胞癌經縮小后可能切除,5年存活率超過結扎聯合化療。切除標本中仍有殘癌,說明二期切除的重要性。
幾乎都有栓塞后綜合癥:間歇性發熱、腹痛、惡心嘔吐和腹脹,可持續1—2周。15%的病人可誤有膽囊動脈栓塞引起膽囊梗死、或一些動脈栓塞引起胰腺炎。這一療法對嚴重肝功損害、門靜脈主干血栓或腎功衰竭的病人是禁忌的。
(3)放射治療;肝細胞癌對放射不敏感,而鄰近器官卻易受放射損傷。可采用局部或半肝照射,如能耐受4000rad以上的放射劑量,療效可望提高。目前可用直線加速器放療,如與肝動脈化療聯合,3年存活率可達60%,部分病人因癌腫縮小可獲二期切除。
(4)物理治療:—196℃液氮冷凍治療簡便、有效、無嚴重并發癥,增加單針和多針冷凍頭同時可治療深部癌腫,對于不能切除的小肝癌,5年存活率可達50%。高功率激光氣化癌結節的儀器設施復雜。微波除用于癌腫切除外,亦可用作固化。
(5)生物治療:僅是一種輔助療法。近年用得較多的有了干擾素、白介素—2、淋巴因子激活殺傷細胞(LAK)等。導向治療以抗體為載體,是廣義的生物學療法,可試用131I結合鐵蛋白抗體或抗人HCC-McAb進行導向。
(6)肝移植:主要優點是清除了已檢出和未檢出的瘤結節、以及所有硬變肝內的癌前病灶,而且移去了病變的肝臟,從而降低了因門脈高壓引起的合并癥發生率及其病死率;主要的缺點是不易獲得供體肝臟、病人須經嚴格選擇、HBV感染病人的早期病死率、以及由于免疫抑制早期腫瘤復發的高危性。自環孢素A(cyclosporineA,CsA)用于抑制免疫排斥后,肝移植的存活率有了明顯提高。肝移植與肝癌切除一樣,其療效取決于腫瘤的大小、個數、有無血管和淋巴腺的侵襲。如<5cm的復發率為7%、而較大的為62%;無大血管侵襲的復發率為29%、而有侵襲的為73%;無淋巴腺轉移的5年存活率可達60%、而有轉移的僅15%。
肝移植應選擇60歲以下、腫瘤小于3cm、無血管或附近淋巴腺侵襲的病人。肝移植后早期(3個月內)死亡因移植排斥;后期則因癌腫復發。在CsA-皮質激素控制下,復發的腫瘤生長迅速,其體積倍增時間僅26-4-11日。
(三)中草藥治療:中草藥扶正抗癌適用于晚期肝癌患者和肝功能嚴重失代償無法耐受其他治療者,可起改善機體全身狀況,延長生命的作用,亦可配合手術、放療和化療以減少不良反應,提高療效。
(四)基因治療:分子腫瘤學的一系列進展,揭示細胞癌變的本質是癌基因產物控制下的細胞增殖、分化失調,原癌基因被激活及/或抑癌基因失活,是腫瘤發生、發展的分子基礎。因而,可用基因調控手段阻斷癌基因表達,從而抑制腫瘤細胞的增殖,甚至逆轉其惡性程度。
治愈標準
原發性肝癌的療效評價標準有以下三種。
1.以腫瘤的體積的變化作為衡量療效的標準其規定如下。
(1)完全緩解:可見腫瘤消失并持續一月以上。
(2)部分緩解:腫瘤兩個最大的相互垂直的直徑乘積縮小50%以上并持續一月以上。
(3)穩定:腫瘤兩個最大的相互垂直的直徑乘積縮小不足50%,增大不超過25%并持續一個月以上。
(4)惡化:腫瘤兩個最大的相互垂直的直徑乘積增大不超過25%。
2.以甲胎蛋白的含量變化作為衡量療效的標準。術后AFP降至正常為手術屬根治的依據。
3.以治療后生存期為衡量療效的標準。治療后病人生存期的長短反映了治療的最終效果,所以是最有價值的療效標準。
相關網上資源:
International Union Against Cancer (UICC,國際抗癌協會)
https://www.uicc.org/
The fight against cancer knows no boundaries, and the International Union Against Cancer (UICC) is the only global cancer organisation with members and activities covering all aspects of cancer control. Founded in 1933, UICC is an independent, international, non-governmental association of 291 member cancer fighting organisations in 87 countries.
Association of European Cancer Leagues (ECL)
https://ecl.uicc.org/
The national voluntary cancer leagues in Europe united their forces in Rome 1980 by establishing the Association of European Cancer Leagues (ECL) to support and promote the activities of the International Union Against Cancer (UICC) in Europe. The statutes of the ECL were drawn up in Lausanne, Switzerland on 27th October 1981. ECL is a non-profit, non-political and non-sectarian association. It is a proactive force with the intention to promote health, to reduce the risk of malignant disease, to promote research and evidence-based treatment in the field of cancer; and to be responsive to the needs of cancer patients, their families and carers.
European Association for Cancer Research (EACR)
https://www.eacr.org/
The aim of the European Association for Cancer Researchis "to advance cancer research by facilitating communication between research workers including the organization of meetings." The membership of the EACR is over 5000 cancer researchers from over 40 European and non-European countries.
European Cancer Prevention Organization (ECP)
https://www.uicc.org/others/ecp/ecp.html
The EUROPEAN CANCER PREVENTION ORGANIZATION was established in 1981 to promote collaboration between scientists working in the various European countries and to use the large population of Europe and their wide range of lifestyles as a laboratory for the study of cancer causation.
Organization of European Cancer Institutes (OECI)
https://www.uicc.org/others/oeci/
The Organization of European Cancer Institutes (OECI) is a non-governmental, non - profit organization founded in Vienna in 1979. The primary objectives of OECI are to improve communication and to increase collaborative activities among European cancer institutes; promoting and strengthening Comprehensive Cancer Centres in Europe with a view to reducing cancer incidence and mortality, and supporting cancer patients. The following priority areas of focus have been identified:
The Cancer Society of Sabah (Malaysia)
https://www.uicc.org/others/sabah/
The Society was formed in 1982 with its main objectives being the prevention and control of cancer in addition to providing relief to patients suffering from cancer. It is listed as a voluntary non-governmental organization and people can become members of the Society by paying a yearly subscription fee. It is also a member of the UICC or the International Union Against Cancer.
Cancer Trials
https://cancertrials.nci.nih.gov
This page offers comprehensive patient information brochure on clinical trials. Also featuring Informed Consent Recommendations and an Informed Consent Template that can be used by researchers.
CancerNet(National Cancer Institute ,NCI)
https://www.cancer.gov/
The National Cancer Institute (NCI) is a component of the National Institutes of Health (NIH), one of eight agencies that compose the Public Health Service (PHS) in the Department of Health and Human Services (DHHS). The NCI, established under the National Cancer Act of 1937, is the Federal Government's principal agency for cancer research and training. The National Cancer Act of 1971 broadened the scope and responsibilities of the NCI and created the National Cancer Program. Over the years, legislative amendments have maintained the NCI authorities and responsibilities and added new information dissemination mandates as well as a requirement to assess the incorporation of state-of-the-art cancer treatments into clinical practice.


